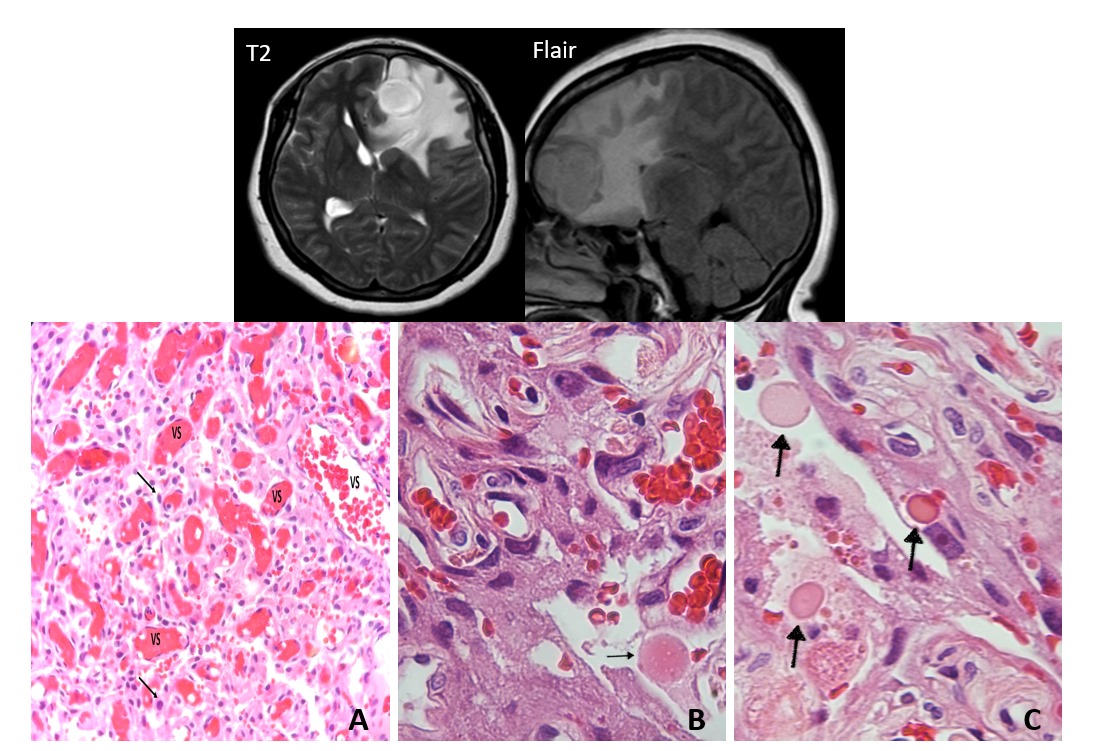
Rezai AR, D'Haese PF, Finomore V, Carpenter J, Ranjan M, Wilhelmsen K, Mehta RI, Wang P, Najib U, Vieira Ligo Teixeira C, Arsiwala T, Tarabishy A, Tirumalai P, Claassen DO, Hodder S, Haut MW. Ultrasound Blood-Brain Barrier Opening and Aducanumab in Alzheimer's Disease. N Engl J Med. 2024 Jan 4;390(1):55-62. doi: 10.1056/NEJMoa2308719. PMID: 38169490.
¿Por qué leer?
Aducanumab es un anticuerpo anti-amiloide que ha sido utilizado para disminuir la concentración de beta-amiloide (Aβ) en el cerebro de personas con enfermedad de Alzheimer. Sin embargo, la barrera hematoencefálica dificulta su penetración al sistema nervioso central. Vale la pena leer este estudio pues propone una nueva técnica para facilitar la penetración de grandes moléculas al sistema nervioso central para el tratamiento de enfermedades neurodegenerativas. El beneficio de utilizar ultrasonido focal junto con aducanumab se había demostrado en estudios preclínicos, pero este es el primer ensayo realizado en humanos.
¿Qué hicieron?
Dos hombres y una mujer con Alzheimer leve, de 59, 64 y 77 años, recibieron infusiones mensuales de aducanumab durante seis meses. Ninguno de los paciente había recibido el anticuerpo con anterioridad.
Cada uno fue seguido para la apertura de la barrera hematoencefálica mediada por ultrasonido focal en áreas cerebrales particulares donde la carga de beta amiloide era alta. La barrera hematoencefálica se cerró a las 24-48 horas.
Los pacientes llevaban un casco de tratamiento que contenía más de 1 000 sondas de ultrasonido en una máquina de resonancia magnética, que guiaba qué áreas debían tratarse. El ultrasonido enfocado solo se aplicó a un lado del cerebro, y el otro sirvió como control.
Los análisis PET con Aβ de regiones de la barrera hematoencefálica abiertas con ultrasonido focal mostraron reducciones en los niveles de Aβ: en el participante 1, el valor centiloide disminuyó de 224.2 a 115.2, en el participante 2, de 185.6 a 104.6, y en el participante 3, de 251.5 a 84.9. Los análisis de las regiones contralaterales homólogas que no estuvieron expuestas a la apertura de la barrera hematoencefálica con ultrasonido focal mostraron niveles similares de Aβ al inicio y en el seguimiento de 26 semanas: en el participante 1: 219.7 y 218.1 centiloides, en el participante 2: 129.3 y 135.8 centiloides, y en el participante 3: 246.9 y 238.4 centiloides.
Los resultados mostraron que las reducciones en las placas amiloides fueron numéricamente mayores en las áreas del cerebro tratadas con ultrasonido que en las áreas que no habían sido tratadas con ultrasonido. La función cognitiva se mantuvo estable en dos pacientes y empeoró en uno en el período posterior al tratamiento combinado de seis meses, sin reperecusión en su funcionalidad.
¿Qué aporta?
Se descubrió que el uso de ultrasonido focal aunado a aducanumab es generalmente seguro, sin ningún informe de inflamación cerebral o anomalías de sangrado que se hayan asociado a los anticuerpos anti-amiloide.
El uso de ultrasonido focal es prometedor para el tratamiento de enfermedades neurodegenerativas, al facilitar la penetración de tratamientos con la apertura de la barrera hematoencefálica.