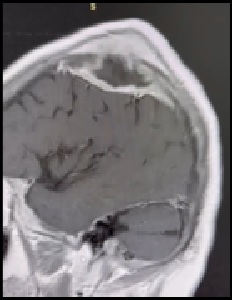
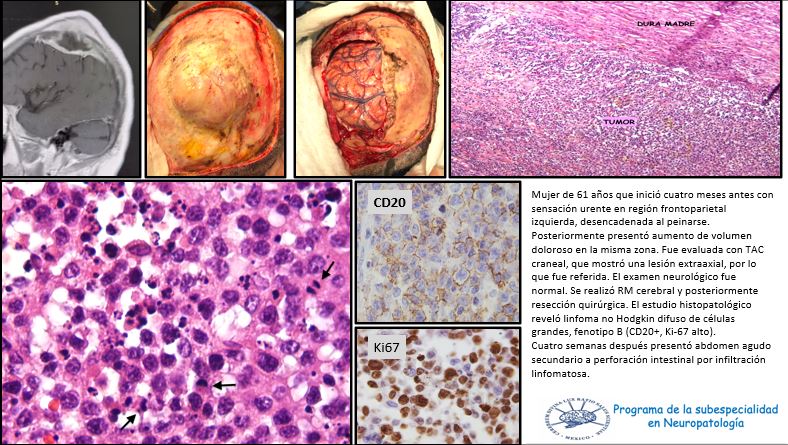
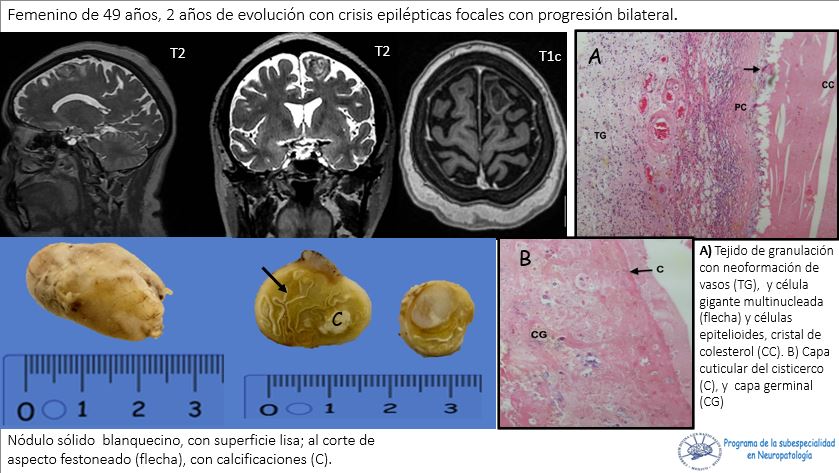
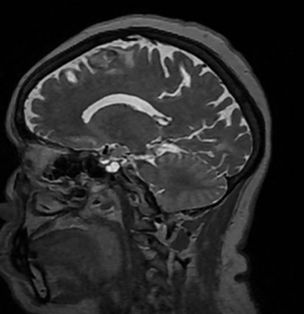
Liu C, Abdalkader M, Sang H, Sarraj A, Campbell BCV, Miao Z, Huo X, Yoo AJ, Zaidat OO, Thomalla G, Bendszus M, Yoshimura S, Uchida K, Li Q, Yuan Z, Siegler JE, Yaghi S, Sun D, Pujara D, Kaesmacher J, Zheng C, Ruan Z, Xu C, Yuan G, Yin C, Yi TY, Li M, Xie D, Yang Q, Qiu Z, Nguyen TN. Endovascular Thrombectomy for Large Ischemic Core Stroke: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Neurology. 2025 May 13;104(9):e213443. doi: 10.1212/WNL.0000000000213443. Epub 2025 Apr 17. PMID: 40245349.
¿Por qué?
La terapia endovascular es el enfoque estándar para tratar el accidente cerebrovascular isquémico agudo (AIS) causado por oclusion de grandes vasos (LVO). Sin embargo, las guías actuales recomiendan EVT solo en pacientes elegibles que no presenten cambios isquémicos tempranos significativos en la tomografía sin contraste inicial, según la puntuación ASPECTS de ≥6. Los pacientes con datos de isquemia más grande (volumen mayor a 50 o 70 mL, ASPECTS de 5 o menos) han sido en gran medida excluidos de los ensayos clínicos previos debido a preocupaciones sobre el riesgo de hemorragia post-reperfusión y edema. Dado que estos pacientes constituyen aproximadamente entre el 8% y el 25% de los casos de LVO, es necesario investigar más la eficacia y seguridad de EVT en ellos.
¿Qué hicieron?
Se realizó una revisión sistemática y meta-análisis. Se buscaron ensayos clínicos aleatorios en bases de datos como PubMed, Embase, Cochrane y ClinicalTrials.gov desde 1980 hasta 2024. Los criterios de inclusión fueron: ser ensayos clínicos aleatorios, incluir pacientes con puntuación ASPECTS ≤5 o volumen de infarcto ≥50 mL, comparar EVT con tratamiento médico estándar, y reportar resultados como escala de Rankin modificada (mRS) a 90 días, mortalidad y hemorragia intracraneal sintomática.
En los resultados seis ensayos clínicos aleatorios (RCTs) que incluyeron a 1,887 pacientes con infartos cerebrales grandes tratados con terapia endovascular (EVT) o tratamiento médico estándar (BMT). La mayoría de los pacientes tenían una edad mediana de 70 años, y la distribución de género fue similar en ambos grupos, sin diferencias significativas en características iniciales como sexo, edad, puntuación NIHSS, ASPECTS, tiempo desde el inicio del stroke hasta la intervención, y uso de trombólisis intravenosa. La calidad de los estudios fue aceptable según la herramienta RoB2.
En cuanto a los resultados, la EVT mostró ser efectiva: a los 90 días, un mayor porcentaje de pacientes alcanzó independencia funcional (mRS 0–3 y 0–2) y hubo una reducción en la mortalidad, aunque esta última no fue estadísticamente significativa en el análisis conjunto (RR 0.9). Sin embargo, EVT aumentó el riesgo de hemorragia intracraneal sintomática (sICH).
¿Qué aporta?
La evidencia respalda que la terapia endovascular puede mejorar los resultados funcionales y reducir la mortalidad en pacientes con infartos grandes, aunque aumenta el riesgo de hemorragias intracraneales, y estos beneficios parecen ser consistentes a través de diferentes subgrupos.